Herz-Kreislauf-Erkrankungen wie Schlaganfall und Herzinfarkt sind mit mehr als 18 Millionen Toten pro Jahr die weltweit häufigste Todesursache. Ein Team von Forschenden des Karlsruher Instituts für Technologie (KIT) identifizierte nun einen neuen Zelltyp in Blutgefäßen, der das Gefäßwachstum entscheidend mitverantwortet. Diese Entdeckung könnte neue therapeutische Strategien zur Behandlung ischämischer Herz-Kreislauf-Erkrankungen ermöglichen, also Erkrankungen, die auf die verminderte oder fehlende Durchblutung von Gewebe zurückgehen. Das Team berichtet in der Fachzeitschrift Nature Communications .
Welches Gewebe braucht welche Verzweigung?
Ein komplexes Netzwerk aus Blutgefäßen verteilt das Blut über alle Organe des Körpers und gewährleistet so, dass die Körperzellen mit genügend Sauerstoff und Nährstoffen versorgt werden, um beispielsweise den Herzschlag und die Gehirnfunktion aufrechtzuerhalten. Verstopfungen von Blutgefäßen und damit Beeinträchtigungen der Sauerstoffzufuhr können zu neuronalem oder kardialem Zelltod führen und in einem Schlaganfall oder Herzinfarkt gipfeln. Die Revaskularisierung – also das Wiederherstellen der Blutversorgung und die Geweberegeneration – erfordern funktionelle Blutgefäße. Wie diese Revaskularisierung von Organen tatsächlich abläuft und wie sie gefördert werden kann, ist noch immer ein ungelöstes klinisches Problem.
Da jedes Organ eine einzigartige physiologische Funktion erfüllt, unterscheiden sich die vaskulären, das heißt die Blutgefäße betreffenden Verzweigungsmuster zwischen den Organen. Wie organspezifische vaskuläre Strukturen entstehen, war lange Zeit ein Rätsel.
Aus therapeutischer Sicht wird angenommen, dass das grundlegende Verständnis der organspezifischen molekularen Steuerung des Gefäßwachstums und der Gefäßverzweigungen einen Schlüssel für die Entwicklung personalisierter Medizinstrategien zur Bekämpfung von Herz-Kreislauf- und neurodegenerativen Erkrankungen bietet.
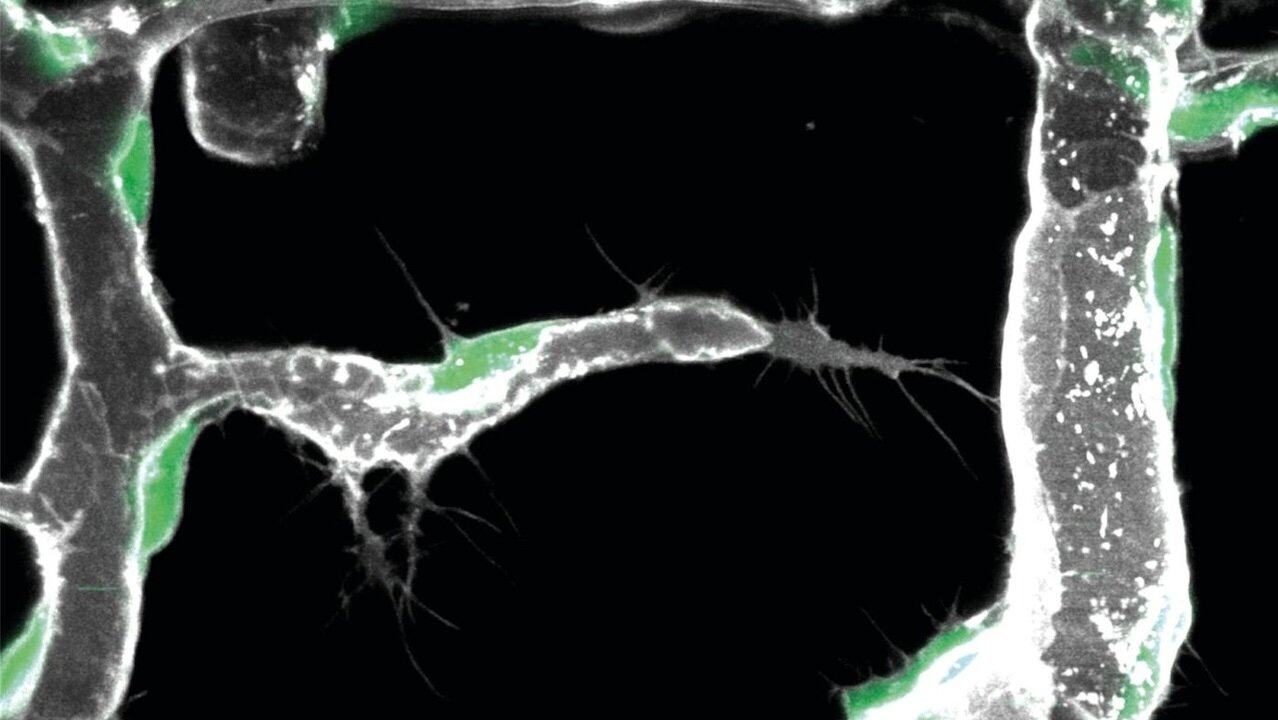
Pionierzellen bewegen sich innerhalb der Gefäßwänd
Wissenschaftlerinnen und Wissenschaftler um Prof. Ferdinand le Noble (KIT), haben nun entdeckt, dass die Aktivierung eines neuen vaskulären Zelltyps ein entscheidendes Element der organabhängigen Variabilität in der vaskulären Verzweigung ist. Diesen Zelltyp nennen sie sie Endotheliale L-Spitzenzelle oder Pionierzelle. Pionierzellen befinden sich innerhalb der inneren Schicht, die das Blutgefäß auskleidet, dem sogenannten Endothel.
Unter Verwendung hochmoderner Bildgebungstechniken fanden die Forschenden heraus, dass sich Pionierzellen innerhalb der Gefäßwand bewegen. Sobald sie mit spezifischen, von der lokalen Umgebung produzierten Signalen in Kontakt kommen, beginnen diese Pionierzellen, neue Blutgefäße zu bilden. Um die molekulare Identität dieser Signale zu klären, die signalproduzierenden Zellen zu identifizieren und vor allem auch den Mechanismus, wie diese Signale wahrgenommen werden, um die Differenzierung von Pionierzellen fördern, verwendeten die Wissenschaftlerinnen und Wissenschaftler eine kürzlich entwickelte Technik namens Einzelzell-Sequenzierung.
Molekülcocktail codiert Ort und Zeit der Gefäßbildung
„Die Einzelzell-Sequenzierung kombiniert detaillierte RNA-Sequenzierung einzelner Zellen mit bioinformatischen Analysen und ermöglicht eine präzise Identifizierung von Zellsubtypen und den Molekülen, die diese Zellen für die Zell-Zell-Kommunikation synthetisieren“, erklärt Dr. Laetitia Préau, Erstautorin der Studie. „Mit dieser Technik haben wir entdeckt, dass die vaskuläre Musterung durch eine spezifische Reihe von Molekülen codiert wird, die nur von einer Untergruppe von Endothelzellen wahrgenommen werden können, um das Gefäßwachstum zu fördern.“
Dieser Molekülcocktail ist organspezifisch und codiert die Anleitung dafür, wie an diesem bestimmten Ort und zu diesem bestimmten Zeitpunkt ein neues Blutgefäß gebildet werden kann. Als Empfänger dieses molekularen Codes dienen ausschließlich die zukünftigen Pionierzellen, die den Code entschlüsseln und vaskuläre Wachstumsprozesse einleiten.
Grundlagen für neue Therapieansätze
Dabei stellte sich heraus, dass mehrere dieser organspezifischen vaskulären Wachstumscode-Moleküle potenziell pharmakologisch manipulierbar sind, also auf von außen zugegebene Chemikalien reagieren. le Noble verdeutlicht: „Um die therapeutischen Möglichkeiten zu erkunden, arbeiten wir mit Expertinnen und Experten aus Chemie, Gewebeingenieurwesen (Tissue Engineering) und KI zusammen. Wir hoffen, neuartige intelligente Moleküle zu identifizieren, um den vaskulären Wachstumsprozess zu beeinflussen, was Patientinnen und Patienten mit ischämischen Herz-Kreislauf-Erkrankungen wie Herzinfarkt und Schlaganfall sowie bestimmten Krebsformen zugutekommen könnte.“
Originalpublikation:
Laetitia Préau, Anna Lischke, Melanie Merkel, Neslihan Oegel, Maria Weissenbruch, Andria Michael, Hongryeol Park, Dietmar Gradl, Christian Kupatt, Ferdinand le Noble: Parenchymal cues define Vegfa-driven venous angiogenesis by activating a sprouting competent venous endothelial subtype. Nature Communications. DOI: 10.1038/s41467-024-47434-x