Das Immunsystem des Gehirns trägt über den Entzündungsbotenstoff IL-12 ursächlich dazu bei, dass sich Alzheimer verschlimmert. Wie der Entzündungsbotenstoff Interleukin-12 (IL-12) das Entstehen und Fortschreiten der Demenz befeuert, konnten jetzt in akribischen Analysen die Teams um Prof. Frank Heppner, Direktor des Instituts für Neuropathologie der Charité, und um Prof. Nikolaus Rajewsky, Direktor des Berliner Instituts für Medizinische Systembiologie des Max Delbrück Center (MDC-BIMSB), zusammen mit weiteren Partnern aufdecken. Ihre Erkenntnisse könnte den Weg zu einer Kombinationstherapie ebnen und den Verfall des Gehirns möglicherweise verlangsamen.
Bisherige Forschung konzentrierte sich auf Ablagerungen im Gehirn
„In der Alzheimer-Forschung wurde jahrzehntelang fast ausschließlich über die charakteristischen Ablagerungen von Amyloid-Beta und Tau diskutiert. Entzündungen galten als Nebeneffekt“, sagt Heppner. „Dass Entzündungsprozesse kausal am Anfang der Kette stehen können, kommt erst allmählich in den Fokus.“ Sein Labor hatte bereits 2012 in der Fachzeitschrift Nature Medicine berichtet, dass eine Blockade der Botenstoffe IL-12 und IL-23 bei Mäusen für Alzheimer typische Hirnveränderungen deutlich reduzieren kann. „Aber wir konnten den Mechanismus nicht aufdröseln – wir kamen mit Standardtechniken nicht weiter“, sagt Heppner. Einzelzellanalysen könnten entscheidende Hinweise geben, hoffte er.
Verklebte und verhedderte Hirnzellen
Im Laufe ihres Lebens greift eine Zelle immer wieder auf Anweisungen zurück, die in ihrem Erbgut enthalten sind und erfährt so, wie sie auf äußere Einflüsse reagieren soll. Mit Einzelzellanalysen können Forschende sie dabei beobachten. Sie können für Tausende Zellen gleichzeitig rekonstruieren, welche Gene welche Zelle gerade abgelesen und in Proteine übersetzt hat. Das Ergebnis sind riesige Datenmengen, die mit Hilfe von künstlicher Intelligenz und maschinellem Lernen ausgewertet werden. Der Haken: Für eine Einzelzellsequenzierung muss man die Zellen in einer Gewebeprobe zunächst sauber voneinander trennen, ohne sie zu beschädigen oder ungewollt zu manipulieren. „Bei alternden Mäusegehirnen – erst recht mit Alzheimerplaques – sind die Zellen aber so verklebt und verheddert, dass das quasi unmöglich ist“, sagt Rajewsky.
Originalveröffentlichung:
Schneeberger S et al. Interleukin-12 signaling drives Alzheimer’s disease pathology through disrupting neuronal and oligodendrocyte homeostasis. Nature Aging Mar 13. doi: 10.1038/s43587-025-00816-2
Mehrere Jahre hat sein Team ein Protokoll perfektioniert, das diese Hürde umschifft: Statt ganzer Zellen lösten die Forschenden die Zellkerne aus dem Hirngewebe und analysierten, welche RNA dort gerade vorlag. Letztlich sequenzierten sie die RNA aus mehr als 80.000 Zellkernen und rekonstruierten außerdem die Kommunikation der Zellen untereinander. „Die beiden Teams haben immer wieder zusammengesessen und diskutiert, was diese hochkomplexen Daten bedeuten“, sagt Rajewsky. „Diese mühevolle Optimierung am Anfang hat sich gelohnt – die Zusammenhänge wären sonst nicht messbar gewesen.“
Wie IL-12 das Alzheimer-Gehirn schädigt
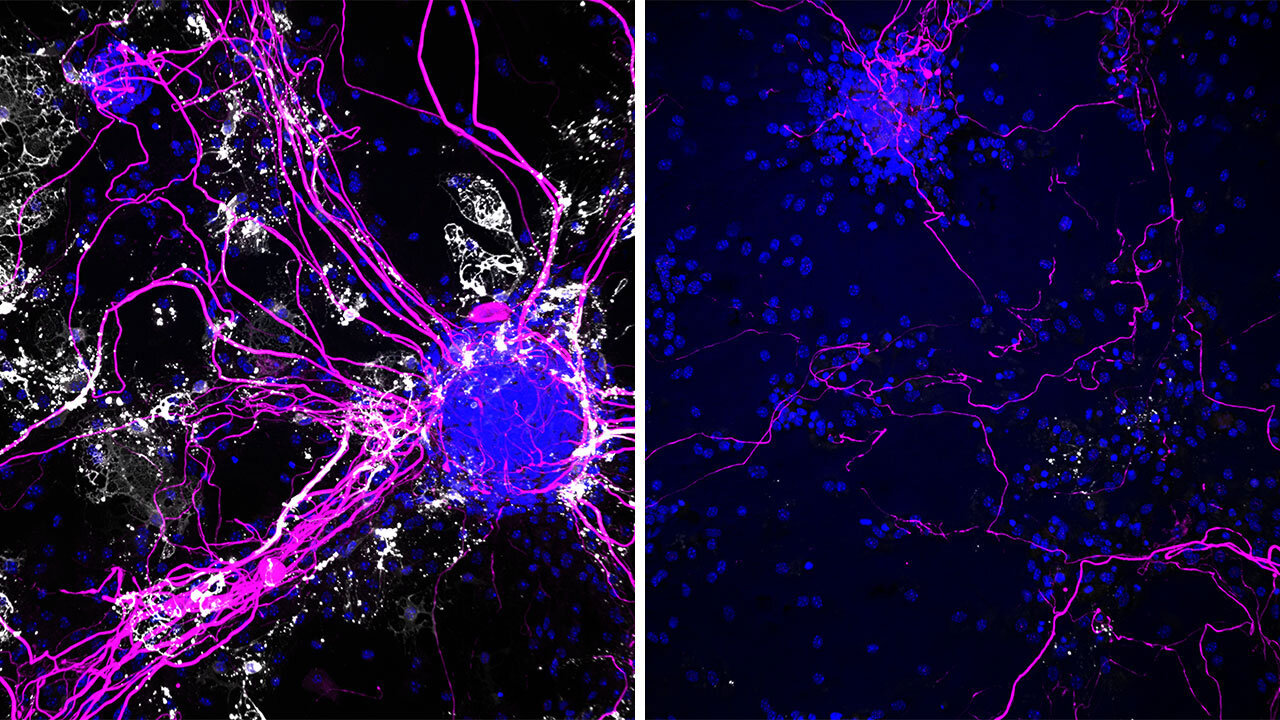
Die Immunzellen des Gehirns, die Mikroglia, sind eigentlich gute Wächter. Sie beseitigen Eindringlinge wie Mikroben, putzen Zellmüll weg – auch die typischen Plaques, die bei Alzheimer entstehen. Doch im alternden Gehirn sind die Mikroglia in den vielfältigsten Zuständen zu finden. Während manche weiterhin gut funktionieren, verlieren andere nach und nach ihre Schutzwirkung und beginnen, dauerhaft in geringen Mengen Entzündungsbotenstoffe zu produzieren. Der Entzündungsbotenstoff IL-12, bislang vor allem von Autoimmunerkrankungen wie Morbus Crohn, rheumatoider Arthritis oder auch Parodontitis bekannt, spielt eine zentrale Rolle bei der Entstehung von Alzheimer. Er schädigt zwei wichtige Zelltypen im Gehirn: Die reifen Oligodendrozyten, die normalerweise die fettreiche Isolierschicht der Nervenfasern, das Myelin, produzieren. Die Isolierschicht ist entscheidend für eine schnelle Signalweiterleitung im Gehirn. Außerdem dockt der Botenstoff bei bestimmten Nervenzellen, den Interneuronen, an und lässt sie absterben. Diese speziellen Nervenzellen sind für Kognition und Gedächtnis besonders wichtig. Ein Teufelskreis beginnt: Je mehr Mikroglia IL-12 produzieren, desto mehr Zellen sind geschädigt. Und die noch funktionalen Mikroglia sind damit abgelenkt, zusätzlichen Zellmüll wegräumen zu müssen, statt Alzheimer-Plaques abzubauen.
Den Mechanismus überprüften die Forschenden in mehreren Schritten bei Mäusen und an menschlichem Gewebe. Wenn das Team um Frank Heppner den Botenstoff in Zellkulturen und im Mausmodell blockierte, konnten sie die krankheitsbedingten Veränderungen eindämmen.
Elektronenmikroskopische Aufnahmen am Max-Planck-Institut für Multidisziplinäre Naturwissenschaften in Göttingen belegten zudem, wie sich Myelin-Struktur und Nervenfaserdichte änderte, wenn bei Mäusen der IL-12-Signalweg vorhanden war oder fehlte.
Massenspektrometrische Analysen an der Universität Zürich bestätigten die veränderte Zusammensetzung der fettreichen Isolierschicht. Als das Team um Frank Heppner Autopsiegewebe von Alzheimer-Betroffenen untersuchte, bestätigte sich der Zusammenhang abermals. Je weiter die Krankheit fortgeschritten war, desto mehr IL-12 fanden sie. Zellkulturen mit menschlichen Oligodendrozyten reagierten außerdem extrem empfindlich auf IL-12.
Ansatz für eine Kombinationstherapie
„Wir haben jetzt ein sehr detailliertes Bild über den Mechanismus und die Einzelzelltechnologien waren dafür ein essenzieller Katalysator. Offen ist nur noch die Frage, welcher Zelltyp zuerst betroffen ist – die Oligodendrozyten, die Interneurone oder beide“, sagt Heppner. Besonders vielversprechend: Es gibt bereits auf dem Markt zugelassene Wirkstoffe, die IL-12 blockieren. Jetzt hofft das Team, dass klinische Kolleginnen und Kollegen die Daten aufgreifen und eine klinische Studie starten. „Wenn sich die Wirkstoffe bewähren, wäre das ein neuer Pfeil im Köcher. Alzheimer hat nicht nur eine Ursache. Eine Achse der Erkrankung wird zumindest bei einem Teil der Patientinnen und Patienten über das Immunsystem mitgesteuert. Wenn wir den Verfall verlangsamen wollen, brauchen wir eine Kombinationstherapie“, erklärt Heppner. Diese könne früh ansetzen. Denn IL-12 kann man als Biomarker im Blut oder in der Hirnflüssigkeit nachweisen.