Aus verrottendem Pflanzenmaterial haben Forschende erstmals einen Bakteriophagen isoliert, der Bakterien im Ruhezustand angreifen und abtöten kann. Wie der Phage das schafft, ist noch unklar. Eine Kombinationstherapie mit diesem Phagen und einem Antibiotikum löscht in Reinkultur und im Mausmodell viele ruhende Keime aus.
In der Natur leben die meisten Bakterien auf Sparflamme. Bei Nährstoffmangel oder Stress fahren sie ihren Stoffwechsel kontrolliert herunter und gehen in einen Ruhezustand über. In diesem Stand-by-Modus laufen zwar noch bestimmte Stoffwechselprozesse ab, die es den Mikroben ermöglichen, ihre Umwelt wahrzunehmen und auf Reize zu reagieren, aber Wachstum und Teilung ruhen.
Dadurch sind Bakterien auch vor Antibiotika oder vor Phagen geschützt, das sind Viren, die ausschließlich Bakterien befallen und abtöten. Phagen gelten als mögliche Alternative zu Antibiotika, die aufgrund von Resistenzen nicht mehr (genügend) wirksam sind. Bisher war die Lehrmeinung, dass Phagen nur dann erfolgreich Bakterien infizieren, wenn diese am Wachsen sind. Forschende der ETH Zürich haben sich gefragt, ob es nicht doch Bakteriophagen gibt, die sich im Lauf der Evolution auf Bakterien im Ruhezustand spezialisiert haben und sich gezielt gegen solche einsetzen ließen.
In Kompostprobe fündig geworden
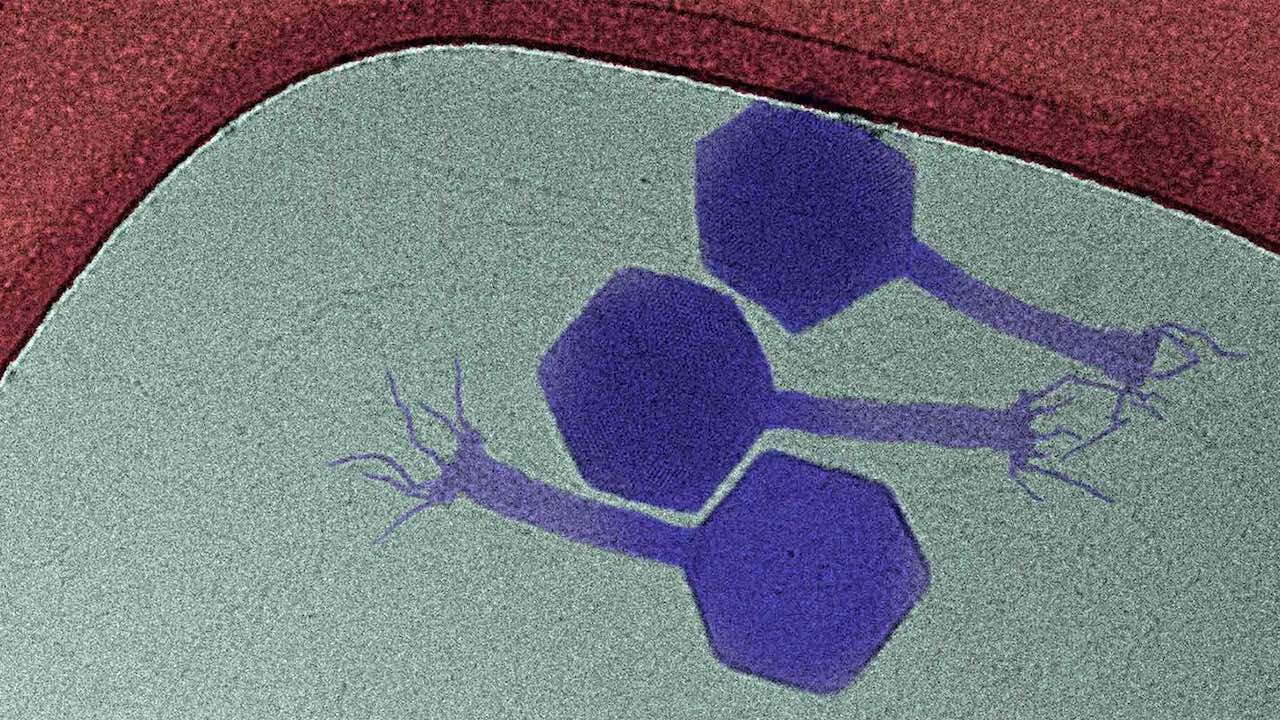
ETH-Professor Alexander Harms und seine Mitarbeitenden starteten 2018 am Biozentrum der Universität Basel mit ihrer Suche. Sie gingen davon aus, im ersten Jahr rund 20 verschiedene Phagen isolieren zu können, die Bakterien im Ruhezustand angreifen. Doch erst 2019 isolierte Harms Doktorand Enea Maffei aus verrottendem Pflanzenmaterial von einem Friedhof bei Riehen (BS) ein neues, bis dato unbekanntes Virus, das schlafende Bakterien befallen und vernichten kann. „Es ist der erste in der Literatur beschrieben Phage, der nachweislich Bakterien im Ruhezustand attackiert“, sagt Maffei. Ihren neuen Phagen haben sie als Paride bezeichnet.
Aktiv gegen weit verbreitetes Bakterium
Das gefundene Virus befällt Pseudomonas aeruginosa, ein Bakterium, das in der Umwelt weit verbreitet ist. Verschiedene Stämme besiedeln Gewässer, Pflanzen, das Erdreich – oder den Menschen. Im Körper können gewisse Stämme schwere Erkrankungen der Atemwege wie Lungenentzündungen auslösen, die tödlich verlaufen können.
Wie der neue Phage schlafende P. aeruginosa-Keime überrumpelt, ist bisher noch nicht klar. Die Forschenden vermuten, dass das Virus einen spezifischen molekularen Schlüssel nutzt, um die Bakterien aufzuwecken und dann die Vervielfältigungsmaschinerie der gekaperten Zelle für die eigene Vermehrung auszunutzen. Wie genau das abläuft, konnten die ETH-Forschenden bisher nicht klären.
Als nächstes geht es den Forschenden darum, die Gene oder Moleküle, die dem Aufweckmechanismus zugrunde liegen, aufzuklären. Darauf basierend könnten sie im Reagenzglas Substanzen entwickeln, die das Wecken übernehmen. Eine solche Substanz könnte dann mit einem geeigneten Antibiotikum, das allein die Bakterien nicht restlos eliminiert, kombiniert werden. „Aber wir stehen erst am Anfang und wissen vor allem eines: dass wir fast nichts wissen“, sagt Harms.
Erste Tests zeigen Wirkung
Um die Wirksamkeit der Paride-Phage zu testen, haben die Forschenden ihn mit dem Antibiotikum Meropenem kombiniert. Dieses stört die Zellwandsynthese und greift also nur in zelluläre Prozesse ein, die die Phagen nicht schädigt. Auf schlafende Bakterien hat dieses Antibiotikum null Wirkung, da diese keine neue Zellwand synthetisieren.
In den Kulturschalentests konnte das Virus 99 Prozent aller schlafenden Bakterien abtöten, ein Prozent blieb erhalten. Erst die Kombination aus Paride-Phagen und Meropenem löschte die Bakterienkultur ganz aus, obwohl letzteres allein keinen erkennbaren Effekt hatte. In einem weiteren Versuch zusammen mit der Ärztin Nina Khanna des Unispitals Basel testete Maffei schließlich diese Kombination auch an Mäusen mit einer chronischen Infektion. Bei der Maus wirkte der Phage oder das Antibiotikum allein nicht besonders gut. Doch das Zusammenspiel von Phagen und Antibiotikum erwies sich als äußerst wirksam. „Damit zeigen wir, dass unsere Entdeckung nicht einfach nur ein Labor-Artefakt ist, sondern auch klinisch relevant sein könnte“, sagt Maffe.
Hoffnungsschimmer für immer?
Über Phagentherapien diskutiert die Fachwelt schon seit mehreren Jahren intensiv. Forschende und Mediziner:innen hoffen, dass sie eines Tages wirkungslos gewordene Antibiotika durch Phagen ersetzen können. Breite Anwendungen fehlen aber weiterhin. Grund dafür sei, dass noch keine umfassenden Studien dazu durchgeführt wurden. „Bisher gibt es fast nur Einzelfallstudien“, sagt Harms.
Studien zur Phagentherapie von Forschenden des Königin Astrid-Krankenhauses in Brüssel zeigten, dass sich der Zustand bei drei Vierteln der Patienten besserte und bei 61 Prozent der behandelten Personen konnten die Bakterien eliminiert werden. Das heißt aber auch, dass bei vier von zehn Patienten die Keime mit Phagentherapien nicht entfernt werden konnten, obwohl die betreffenden Bakterien im Labor phagenempfindlich waren. „Es könnte vielleicht daran liegen, dass gerade bei chronischen Infektionen viele Bakterien im Körper im Ruhezustand sind und deshalb auch für Phagen nicht zu knacken sind“, sagt Harms. Schlafende Bakterien könnten zudem auch bei Infektionen mit nicht-resistenten Stämmen eine wichtige Rolle spielen.„Bei Infektionen wäre es deshalb wichtig, den physiologischen Zustand der betreffenden Bakterien zu kennen. Dann könnte man gezielt die richtigen Phagen, kombiniert mit Antibiotika, einsetzen. Man muss allerdings genau wissen, wie ein Phage ein Bakterium angreift, um für eine jeweilige Behandlung die richtigen Phagen auszusuchen. Das passiert bisher nicht, weil wir über die Phagen nach wie vor zu wenig wissen“, erklärt Harms. Die Forscher werden deshalb in den kommenden Jahren genau erforschen, wie der neue Phage Bakterien aus dem Tiefschlaf holt, infiziert und für Antibiotika empfänglich macht.