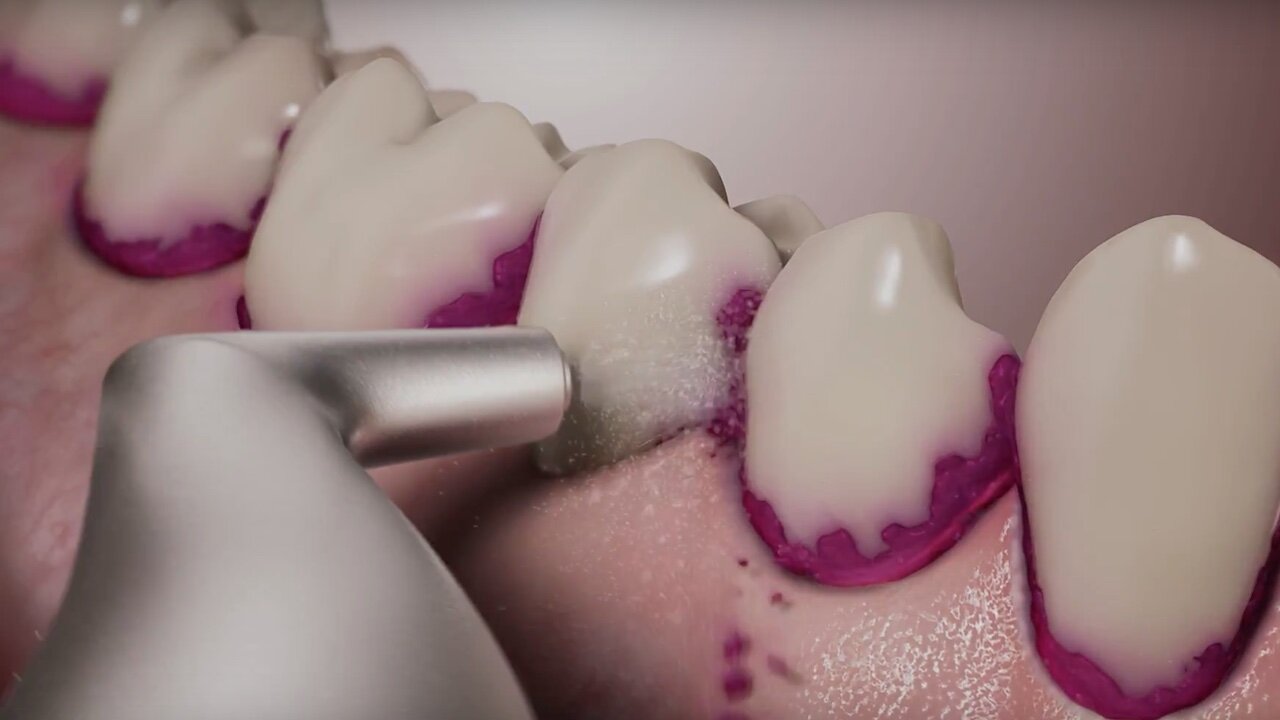
Airpolishing oder auch Air-Flowing wird in vielen Zahnarztpraxen mit Erfolg in der Prophylaxe, aber auch in der Parodontaltherapie eingesetzt. Allerdings findet das Verfahren in den aktuellen Leitlinien zur Behandlung der Parodontitis noch keine Berücksichtigung. Prof. em. Dr. Ulrich Schlagenhauf, international anerkannter Parodontologe und früherer Leiter der Abteilung Parodontologie am Uniklinikum Würzburg, forscht seit Jahrzehnten zu Parodontitis und Parodontaltherapie.
Im Dezember 2021 erschien im „Journal of Periodontology“ eine neue Studie des Würzburger Teams Prof. Schlagenhauf, Dr. Jeanine V. Hess, Dr. Peggy Stölzel, Dr. Imme Haubitz und Prof. Yvonne Jockel-Schneider, in dem ein zweistufiges subgingivales Instrumentierungsschema unter Einbeziehung von Air-Flowing im Hinblick auf den Attachmentgewinn untersucht wurde (Schlagenhauf, U, Hess, JV, Stölzel, P, Haubitz, I, Jockel-Schneider, Y. Impact of a two-stage subgingival instrumentation scheme involving air polishing on attachment gain after active periodontal therapy. J Periodontol 2022; 00 1– 10. https://doi.org/10.1002/JPER.21-0351, Open Access). Air-Flowing ist das von der Firma EMS entwickelte Konzept als Synergie aus dem Airflow Prophylaxis Master, den entsprechenden Handstücken und dem Airflow-Plus-Pulver auf Erythritol-Basis. Im Interview mit Dr. Klaus-Dieter Bastendorf, Esslingen, und Uwe Meyer, Verwaltungsratsmitglied bei EMS (Nyon/Schweiz) sprach Schlagenhauf im Frühjahr 2022 über die Ergebnisse der Studie und die Einsatzmöglichkeiten von Airpolishing in der Parodontaltherapie. Um die zahlreichen Grundlagen und Quellen seiner Aussagen für die wissenschaftlich interessierten Leserinnen und Leser zugänglich zu machen, hat Prof. Schlagenhauf diese in der Studie zitierten Quellen freundlicherweise für den schnelleren Zugriff für das Interview ergänzt.
Herr Prof. Schlagenhauf, vielen Dank, dass Sie sich Zeit für dieses Interview genommen haben. Konnte die Hypothese Ihrer Arbeit, dass das Granulationsgewebe in tiefen, infraalveolären Taschen die Fähigkeit zur Autoregeneration besitzt, bestätigt werden?6,7,8,9,10

Quintessence News
In einer kontrollierten klinischen Studie haben wir nun diese Hypothese an 44 Patienten mit unbehandelter Parodontitis Stadium III/Grad B oder C untersucht. Dabei wurde in der Testgruppe, die antiinfektiöse Therapie im subgingivalen Bereich alleine mit dem Airflow Prophylaxis Master (Pulverstrahlgerät) unter Einsatz des niedrigabrasiven EMS Plus Pulvers durchgeführt.11-18 Dies bedeutete, dass vorhandener subgingivaler Zahnstein bewusst nur von anhaftenden weichen bakteriellen Biofilmen gereinigt und poliert, aber nicht entfernt wurde. In der Kontrollgruppe kam hingegen eine allgemein übliche, den aktuellen Leitlinien entsprechende Reinigung mittels Scalern und Küretten zum Einsatz.
Da Scaling und Root Planing den aktuellen Standard zur Therapie parodontaler Erkrankungen darstellt, musste aus ethischen Gründen, nach einem ersten Heilungsintervall von 28 Tagen, auch in der Testgruppe der subgingivale Zahnstein mittels Scaling und Root Planing entfernt werden. Ab diesem Zeitpunkt waren daher die Wurzeloberflächen in beiden Gruppen vergleichbar frei von mineralisierten und weichen bakteriellen Belägen. Unsere Annahme, dass die initiale Beschränkung der Therapie auf die weniger invasive subgingivale Pulverstrahlreinigung nach sechs Monaten am Studienende zu einem verbesserten Attachmentgewinn führen würde, bewahrheitete sich jedoch nicht. Statistisch konnte bezüglich des Attachmentgewinns kein Vorteil unseres zweistufigen Reinigungsansatzes festgestellt werden.
Bei einer genauen Analyse des zeitlichen Heilungsverlaufs fiel jedoch auf, dass die Abheilung der parodontalen Entzündung während der ersten 28 Tage in beiden Gruppen ohne signifikante Unterschiede verlief. Das heißt, obwohl in der Testgruppe subgingivaler Zahnstein nicht entfernt wurde, sondern die Taschen nur von bakteriellen Biofilmen befreit wurden, war der Rückgang der subgingivalen Entzündung – ausgedrückt als Rückgang der Anzahl der auf Sondierung blutenden Taschen – in beiden experimentellen Gruppen gleich stark ausgeprägt. Das ist an sich schon eine bemerkenswerte Beobachtung, da immer noch viele Parodontologen der intensiven mechanischen Instrumentierung der Wurzeloberflächen und damit der vollständigen mechanischen Entfernung von mit subgingivalem Zahnstein und Plaque behaftetem Wurzelzement eine zentrale Bedeutung zumessen.
Die neue S3-Parodontitis-Leitlinie der Deutschen Gesellschaft für Parodontologie, basierend auf den EFP-Leitlinien von 2018, nahm auch zur subgingivalen Instrumentierung „Scaling versus Nicht-Scaling“ Stellung. Die Literatur zu diesem Thema ist sehr dürftig. Haben Sie nicht mit Ihrer Arbeit durch die 28-Tage-Ergebnisse einen wesentlichen Beitrag geleistet?
Schlagenhauf: Ja, ich denke schon, dass unsere Daten neue Denkanstöße geben werden. Da die Publikation unserer Studie jedoch gerade erst veröffentlicht wurde, konnten die daraus resultierenden Erkenntnisse noch nicht in die aktuellen Leitlinien einfließen.
Die Ergebnisse vor allem nach 28 Tagen zeigen, dass Airflow allein in der Initialtherapie gleiche Ergebnisse erzielt wie das klassische SRP. Wäre es möglich, dass das neue Perioflow-System, das speziell für tiefe Taschen mit mehr als vier Millimetern Taschentiefe entwickelt wurde, bessere Ergebnisse bringen könnte?
Schlagenhauf: Dies ist prinzipiell sicherlich denkbar und ein möglicher Schwachpunkt unseres Studiendesigns. Allerdings kann das Einführen des Nozzle-Aufsatzes in die parodontale Tasche potenziell auch zu einer zusätzlichen mechanischen Belastung des entzündeten Weichgewebes führen, weshalb wir in der aktuellen Studie das Plus-Pulver nur von paragingival, also von außerhalb der Taschen, in die Taschen appliziert haben.
Studie über einen längeren Zeitraum ist geplant
In der Parodontologie werden bei tiefen Taschen oft Antibiotika als Adjuvans eingesetzt, wäre ein weitere Gruppe mit antibiotischer Begleittherapie angezeigt gewesen?
Schlagenhauf: Das ist ein wichtiger Punkt. Unsere Studienpatienten hatten alle multiple tiefe parodontale Taschen ≥ 6 Millimeter Sondierungstiefe. Sie waren damit eine Studienkohorte mit hoher Erkrankungsintensität, bei welcher der adjuvante Einsatz systemischer Antibiotika begleitend zur mechanischen Taschenreinigung die Abheilung der parodontalen Entzündung signifikant verbessert, die ansonsten meist nur durch eine Kombination von geschlossener und chirurgisch-offener Kürettage befriedigend unter Kontrolle zu bringen ist.
Wäre es sinnvoll, die Airflow-Gruppe über einen längeren Zeitraum vergleichend zu untersuchen – vorausgesetzt, die Ethik-Kommission würde einem solchen Vorgehen zustimmen? Wie lange müsste eine solche Untersuchung laufen, um aussagekräftige Ergebnisse zu erhalten?
Schlagenhauf: Unsere Analyse des Heilungsverlaufs in beiden experimentellen Gruppen zeigte, dass die nach 28 Tagen auch in der Testgruppe durchgeführte Reinigung und Anfrischung der subgingivalen Wurzelflächen mittels Küretten die Abheilung in der Testgruppe nicht beschleunigte, sondern vielmehr im Vergleich zur Kontrollgruppe eher hemmte. Die Gründe hierfür sind unklar.
Wir wissen, dass parodontale Abheilungsprozesse langsam ablaufen und dass die dabei ablaufenden Umbauprozesse im Parodontium häufig selbst nach einem Jahr noch nicht vollständig abgeschlossen sind. Eine unvermeidlich traumatische mechanische Bearbeitung der subgingivalen Wurzelflächen in dieser frühen Phase der Abheilung hat diese möglicherweise signifikant beeinträchtigt.
In geplanten Nachfolgestudien wollen wir daher das Intervall zwischen minimal-invasiver Airflow-Pulverstrahlreinigung und nachfolgender mechanischer Entfernung der mineralisierten Biofilme auf drei Monate ausdehnen. Da in der aktuellen Studie, wie bereits erwähnt, die initiale Weichsgewebsheilung der nur mit Pulverstrahlreinigung behandelten Patienten im Vergleich zur mittels Scaling und Root Planing behandelten Kontrollgruppe absolut gleich und unauffällig verlief, würde ein solches Vorgehen sicherlich kein relevantes gesundheitliches Risiko für die an der Studie teilnehmenden Patienten darstellen.
Pulverstrahlanwendung bei Aktualisierung der Leitlinien betrachten
Es gibt eine Anzahl von Veröffentlichungen, die zeigen, dass Airflow als Adjuvans in der antiinfektiösen Therapie hilfreich ist. Die EFP und die DG-PARO erwähnen das Verfahren in ihren Leitlinien jedoch nicht?
Schlagenhauf: Es ist in der Tat ungewöhnlich, dass trotz einer breiten verfügbaren Datenbasis weder Airflow noch andere Pulverstrahlreinigungsverfahren in den von der EFP und DG PARO herausgegebenen Leitlinien namentlich erwähnt werden, während gleichzeitig der klinische Nutzen anderer alternativer Therapieverfahren wie etwa der adjuvanten Applikation von Lasern oder der photodynamischen Therapie eingehend durch Metaanalysen evaluiert wurde. Die Hintergründe hierfür sind mir leider nicht bekannt. Ich werde mich aber aktiv dafür einsetzen, dass sich dies bei regelmäßig anstehenden Aktualisierungen der Leitlinien ändern wird.
Die 28-Tage-Ergebnisse könnten auch eine Auswirkung auf das langfristige Vorgehen bei der UPT, der Unterstützenden Parodontaltherapie haben. Ist es in Zukunft denkbar, dass alle drei Monate ein supra- und subgingivales Biofilmmanagement mit Airflow ohne Einsatz von Hand- oder Maschinen-Instrumenten möglich ist?
Schlagenhauf: Eine alleinige Reinigung parodontaler Taschen mittels Airflow-Pulverstrahlreinigung im Rahmen der UPT ist durch unsere Studienergebnisse zumindest denkbar und wäre unter Kosten- und Zeitgesichtspunkten sicher eine attraktive Alternative zum traditionellen Vorgehen. Die Gleichwertigkeit dieses Vorgehens sollte aber zuvor durch weitere entsprechende kontrollierte klinische Studien abgesichert werden.
Sie haben keine Daten zur Patienten- und Behandler-Zufriedenheit erfasst. Können sie uns ihre subjektiven Eindrücke zu diesen Punkten schildern?
Schlagenhauf: Wir haben dazu tatsächlich keine systematisch erfassten Daten, sondern nur das eventuelle Auftreten unerwarteter Nebenwirkungen beider untersuchter Therapieverfahren dokumentiert. Hier gab es weder seitens der initial mit Airflow behandelten Patienten noch von den konventionell behandelten Kontrollpatienten entsprechende Rückmeldungen. Diverse Patienten aus der Testgruppe erzählten jedoch bei ersten Kontrollterminen spontan, dass sie von der geringen Schmerzhaftigkeit der Pulverstrahlreinigung angenehm überrascht worden waren. Auch für den Behandler ist die Pulverstrahlreinigung aufgrund der einfachen Handhabung und des im Vergleich zum konventionellen Vorgehen merkbar reduzierten Zeitbedarfs meines Erachtens eine attraktive Option.
Maßstab ist belegte Äquivalenz oder Überlegenheit
Was halten Sie von der modifizierten Aussage von Listl und Birch, 2013: „Wird die Integration einer neuen Therapie erwogen, sollte diese in klinischen und mikrobiologischen Resultaten oder Substanzerhaltung überlegen sein und/oder zusätzliche relevante Aspekte bieten, wie Patienten- und Behandler-Zufriedenheit, Zeitersparnis oder Wirtschaftlichkeit“?
Schlagenhauf: Den entscheidenden Maßstab für den Ersatz bewährter Therapieverfahren durch innovative Methoden sollte meines Erachtens immer zuerst eine durch die Ergebnisse kontrollierter klinischer Studien belegte Überlegenheit – oder zumindest Äquivalenz – des Behandlungsergebnisses darstellen. Klinisch äquivalent wirksame neue Verfahren können insbesondere dann interessant sein, wenn ihr Einsatz kostengünstiger oder für die Patienten subjektiv angenehmer ausfällt.
Würden Sie das Airflow-Verfahren unter diesem Aspekt als Standard in antiinfektiöser Therapie und UPT empfehlen?
Schlagenhauf: Diese Pulverstrahlreinigung mittels niedrigabrasiver Pulver wie Glycin oder Erythritol ist an der Würzburger Parodontologie seit mehr als 20 Jahren ein integraler Bestandteil des parodontologischen Behandlungsspektrums, welches bei uns bei nahezu allen Patienten routinemäßig zur Anwendung kommt. Eine bestimmungsmäßige Anwendung vorausgesetzt, kann ich es daher vorbehaltlos für den Einsatz in der antiinfektiösen Therapie und der UPT empfehlen.
Englische Fassung hier/English Version here.
Literatur
Originalstudie: Schlagenhauf, U, Hess, JV, Stölzel, P, Haubitz, I, Jockel-Schneider, Y. Impact of a two-stage subgingival instrumentation scheme involving air polishing on attachment gain after active periodontal therapy. J Periodontol 2022; 00 1– 10. https://doi.org/10.1002/JPER.21-0351
Referenzen aus der Originalarbeit von Prof. Schlagenhauf, auf die er sich im Interview bezieht
1. Jones WA, O’Leary TJ. The effectiveness of in vivo root planning in removing bacterial endotoxin from the roots of periodontally involved teeth. J Periodontol. 1978;49:337-342.
2. O’Leary TJ. The impact of research on scaling and root planing. J Periodontol. 1986;57:69-75.
3. Suvan J, Leira Y, Moreno Sancho FM, Graziani F, Derks J, Tomasi C. Subgingival instrumentation for treatment of periodontitis. A systematic review. J Clin Periodontol. 2020;47(Suppl 22):155-175.
4. Zappa U, Cadosch J, Simona C, Graf H, Case D. In vivo scaling and root planing forces. J Periodontol. 1991;62:335-340.
5. Rupf S, Brader I,Vonderlind D, et al. In vitro, clinical, and microbiological evaluation of a linear oscillating device for scaling and root planing. J Periodontol. 2005;76:1942-1949.
6. Saygin NE, Giannobile WV, Somerman MJ. Molecular and cell biology of cementum. Periodontol 2000. 2000;24:73-98.
7. Narayanan AS, Bartold PM. Biochemistry of periodontal connective tissues and their regeneration: a current perspective. Connect Tissue Res. 1996;34:191-201.
8. Kaufmann ME, Wiedemeier DB, Zellweger U, Solderer A, Attin T, Schmidlin PR. Gingival recession after scaling and root planing with or without systemic metronidazole and amoxicillin: a re-review. Clin Oral Investig. 2020;24: 1091-1100.
9. Lindhe J, Nyman S. Scaling and granulation tissue removal in periodontal therapy. J Clin Periodontol. 1985;12:374-388.
10. Richardson AC, Chadroff B, Bowers GM. The apical location of calculus within the intrabony defect. J Periodontol. 1990;61:118-122.
11. Cobb CM, Daubert DM, Davis K, et al. Consensus conference findings on supragingival and subgingival air polishing. Compend Contin Educ Dent. 2017;38:e1-e4.
12. Nascimento GG, Leite FRM, Pennisi PRC, Lopez R, Paranhos LR. Use of air polishing for supra- and subgingival biofilm removal for treatment of residual periodontal pockets and supportive periodontal care: a systematic review. Clin Oral Investig. 2021;25:779-795.
13. Tsang YC, Corbet EF, Jin LJ. Subgingival glycine powder airpolishing as an additional approach to nonsurgical periodontal therapy in subjects with untreated chronic periodontitis. J Periodontal Res. 2018;53:440-445.
14. Petersilka GJ. Subgingival air-polishing in the treatment of periodontal biofilm infections. Periodontol 2000. 2011;55:124-142.
15. Petersilka GJ, Tunkel J, Barakos K, Heinecke A, Haberlein I, Flemmig TF. Subgingival plaque removal at interdental sites using a low-abrasive air polishing powder. J Periodontol. 2003;74:307-311.
16. Muller N, Moene R, Cancela JA, Mombelli A. Subgingival airpolishing with erythritol during periodontal maintenance: randomized clinical trial of twelve months. J Clin Periodontol. 2014;41:883-889.
17. Hagi TT, Hofmanner P, Salvi GE, Ramseier CA, Sculean A. Clinical outcomes following subgingival application of a novel erythritol powder by means of air polishing in supportive
periodontal therapy: a randomized, controlled clinical study. Quintessence Int. 2013;44:753-761.
18. Moene R, Decaillet F, Andersen E, Mombelli A. Subgingival plaque removal using a new air-polishing device. J Periodontol 2010;81:79-88.
19. O’Leary TJ, Drake RB, Naylor JE. The plaque control record. J Periodontol. 1972;43:38.
20. Schulz KF, Altman DG, Moher D. Group C. CONSORT 2010 statement: updated guidelines for reporting parallel group randomized trials. PLoS Med. 2010;7:e1000251.
21. Cobb CM, Sottosanti JS.Are-evaluation of scaling and root planing. J Periodontol. 2021;92:1370-1378.
22. Hammerle CH, Giannobile WV. Working Group 1 of the European Workshop on P. Biology of soft tissue wound healing and regeneration–consensus report of Group 1 of the 10th European Workshop on Periodontology. J Clin Periodontol. 2014;41(Suppl 15):S1-S5.
23. Eickholz P, Koch R, Kocher T, et al. Clinical benefits of systemic amoxicillin/metronidazole may depend on periodontitis severity and patients’ age: an exploratory sub-analysis of the ABPARO trial. J Clin Periodontol. 2019;46:491-501.